西南大学在STTT系统阐述DNA/RNA/蛋白质甲基化在健康和疾病中的作用及新的治疗策略
发布时间:2023-08-31 10:28:51
遗传信息遵从中心法则从DNA到RNA再到蛋白质的适当传递对细胞命运控制、发育和健康至关重要。信息的流动受到DNA、RNA、蛋白质上各种合成后修饰的精细调控,比如磷酸化、乙酰化和甲基化等。甲基化可以发生在DNA、RNA、组蛋白和非组蛋白上,以S-腺苷甲硫氨酸 (SAM)作为甲基的供体在甲基转移酶(“Writer”)的催化下取代底物分子上的一个氢原子。甲基化可以被不同的识别蛋白(“Reader”)读取以发挥丰富的生物学功能,或者以不依赖特定reader的形式发挥效应。写入的甲基化信息可以被去甲基化酶擦除(“Eraser”),这种动态修饰和读取的性质突出了其在生理调控中的关键作用。由基因突变或环境刺激引发的异常甲基化会促进各种疾病并加速衰老,亟需开发合适的治疗方法来矫正失衡的甲基化状态。甲基化途径的功能高度依赖于具体的细胞环境,这使得解释它们在疾病中的作用变得复杂和困难,阻碍了疾病驱动甲基化靶点的发掘。
2023年8月25日,西南大学医学研究院崔红娟教授团队在《Signal Transduction and Targeted Therapy》(影响因子39.3,中科院一区Top)上发表了题为“Methylation across the central dogma in health and diseases: new therapeutic strategies”的综述文章。全文近5万字,引文815篇,全面介绍了横跨中心法则的甲基化体系的组成及其内部联系,梳理了甲基化失调促进神经系统疾病、癌症和衰老的最新进展和机制,分析汇总了主流和新兴的治疗药物及其优缺点,讨论了甲基化领域未来的机遇和挑战。DNA、RNA或蛋白质的甲基化在过去常作为表观基因组学、表观转录组学或翻译后修饰蛋白质组学的一部分被单独审视,不同甲基化途径之间的联系往往被忽视。因此,本文为DNA/RNA/蛋白质甲基化提供了一个系统的视角和整合性框架,助力甲基化在CRISPR和机器学习时代下更好地服务于基础研究和临床应用。

尽管基于甲基化的治疗补救的基本逻辑已经建立,但临床实践并没有取得预期的结果。目前靶向甲基化/去甲基化酶的小分子化合物只在某些癌症中取得了一定的成功。抑制剂/激动剂介导的全基因组、全转录组或全蛋白组范围内的甲基化扰动会导致不良的生物学效应和细胞毒性,这极大地限制了它们的实际应用,特别是对于单基因疾病(如脆性X 综合征)和多基因且甲基化变化方向不同的疾病(如癌症)或其它健康问题。新兴的甲基化编辑工具能实现位点特异性甲基化/去甲基化操纵,有望解决上述困境。“工欲善其事,必先利其器”,随着甲基化编辑器的效率、稳定性、和免疫原性等特性的进一步改良,以及体内递送系统的改进,它们将有力地推动甲基化在临床治疗中的应用(图1)。
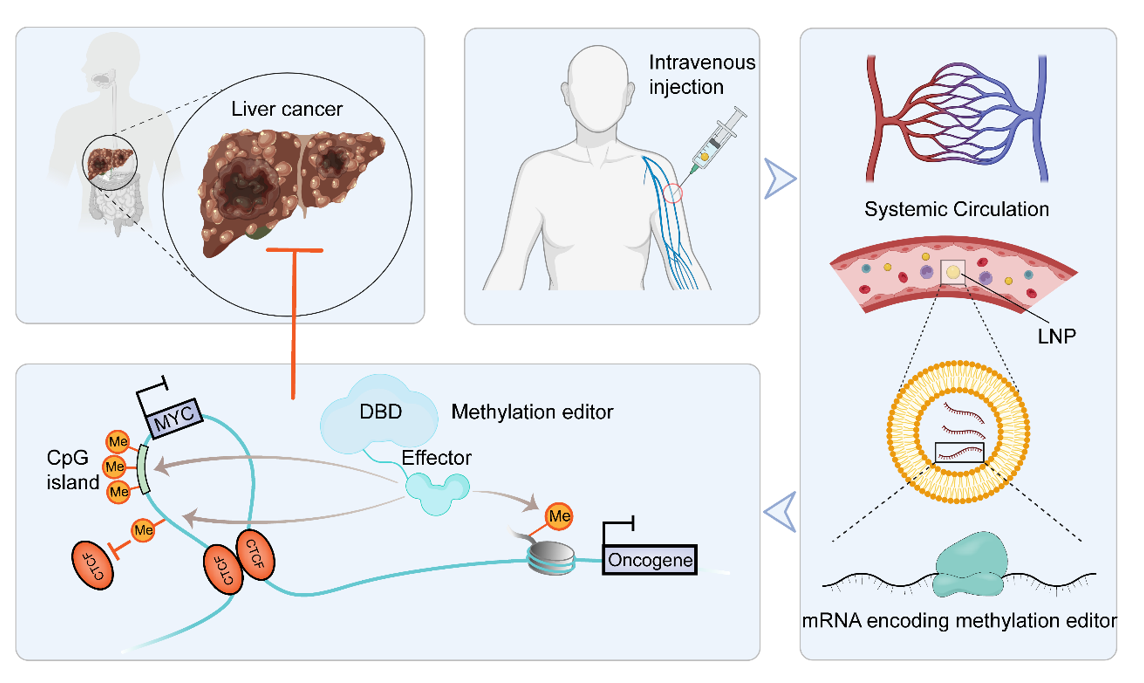
图1 位点特异性编辑染色质甲基化状态用于癌症精准治疗
同时,特定位点或基因的甲基化改变与疾病表型之间的因果关系和潜在机制有望被彻底解答,这是目前基于基因缺失/过表达的模拟模型难以实现的。未来的诊断和最佳个体化治疗方案的选择将依赖于这些新的知识。比如,基于DNA甲基化的非侵入性液体活检技术在癌症早期检测、预后和治疗监测等方面具有很好的应用前景,有望极大地改善癌症病人的生存现状。发掘最具信息量的独立或组合的DNA甲基化生物标志物对未来的成功至关重要,当甲基化标志物单独或与其它癌症标志物(如cfDNA突变)联合使用。此外,就像我们不能只关注DNA甲基化而忽视RNA和蛋白质甲基化在IDH突变驱动的癌症中的重要作用一样(图2),RNA和蛋白质甲基化可以作为正交预测因子,同步检测DNA/RNA/蛋白质甲基化可能会提高基于组织活检甚至液体活检的诊断能力(特别是在代谢紊乱的疾病中)。
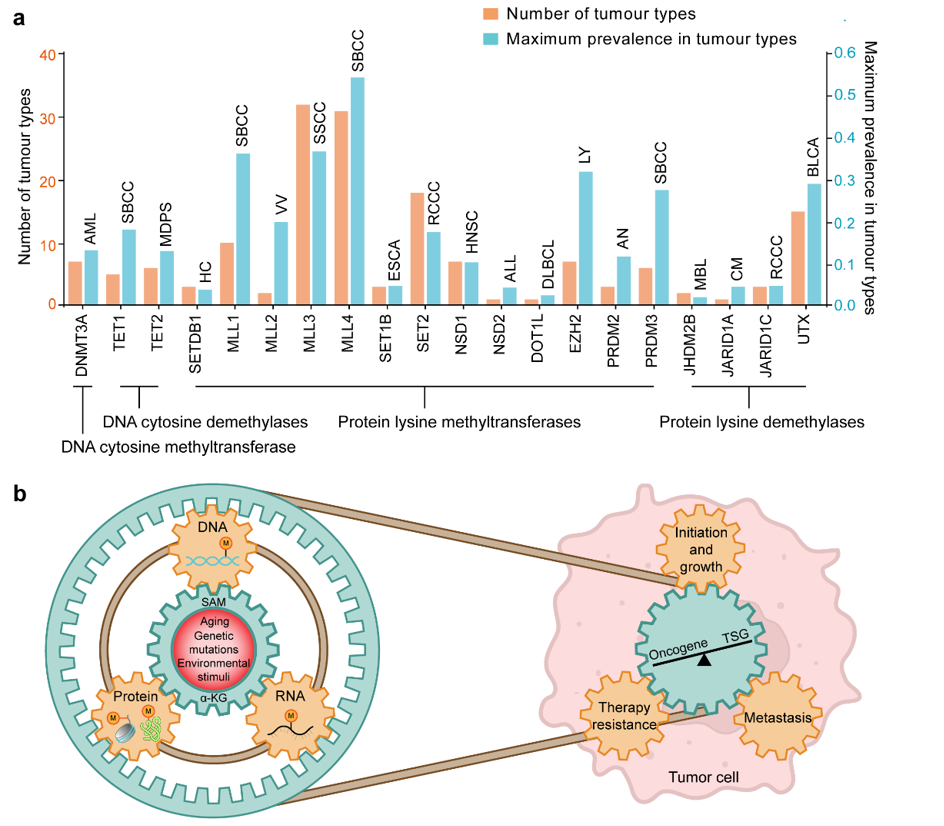
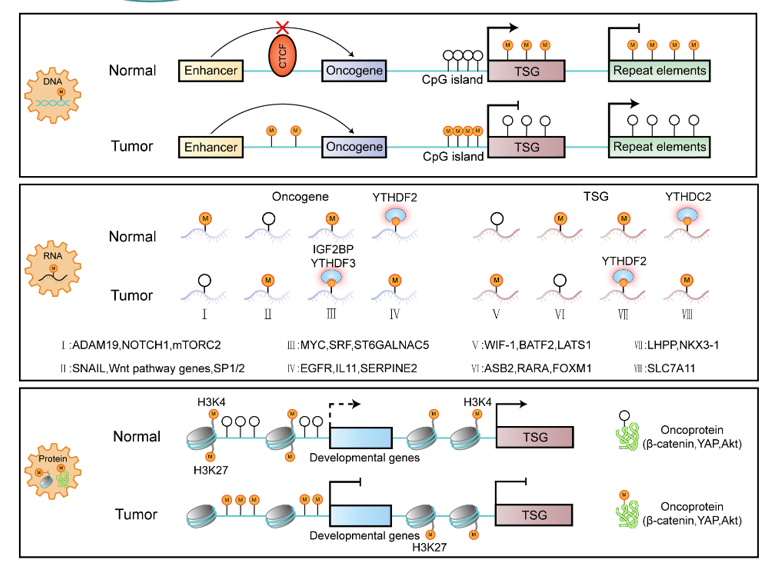
图2 癌症相关甲基化修饰基因突变统计及甲基化失调在肿瘤发生发展中的作用机制
西南大学博士后刘若尘为论文第一作者,崔红娟教授为论文通讯作者。
另外,团队于2020年2月7日在该杂志发表综述论文“Targeting cancer stem cell pathways for cancer therapy”,系统总结了肿瘤干细胞的特征和鉴定,描述了调节肿瘤干细胞发生的主要因子和通路,并讨论了潜在的靶向治疗策略和面临的挑战。目前该论文被引用次数已超过920次,曾荣获《Signal Transduction and Targeted Therapy》杂志2020年度最佳论文奖。
