免疫学研究中心周洋博士在炎性小体研究领域取得新进展
发布时间:2020-05-29 11:17:53
2020年5月14日,我校医学研究院免疫学研究中心周洋博士和赵建军博士合作在Cells杂志(影响因子5.656)发表 “The Roles of Endoplasmic Reticulum in NLRP3 Inflammasome Activation(内质网在NLRP3炎性小体激活中的作用)”。周洋博士作为第一作者兼通讯作者。
炎症是一把双刃剑,在机体收到损伤和感染时发挥防御作用,但验证强度过大或持续时间过长对机体产生损害作用。内质网是一个大的、动态的内膜腔,与其他细胞器,如线粒体和溶酶体,在结构和功能上紧密联系,调控细胞信号转导。内质网参与蛋白质折叠、运输和脂质合成,当内质网内错误折叠的蛋白超过内质网的处理能力时,称为内质网应激。在机体受到损伤和感染时NLRP3炎性小体激活,内质网应激在此过程中发挥重要作用。脂质紊乱、胆固醇迁移到内质网和识别内质网应激的传感器IRE1α和PERK通过调控NLRP3的亚细胞定位和钙离子迁移激活NLRP3炎性小体。
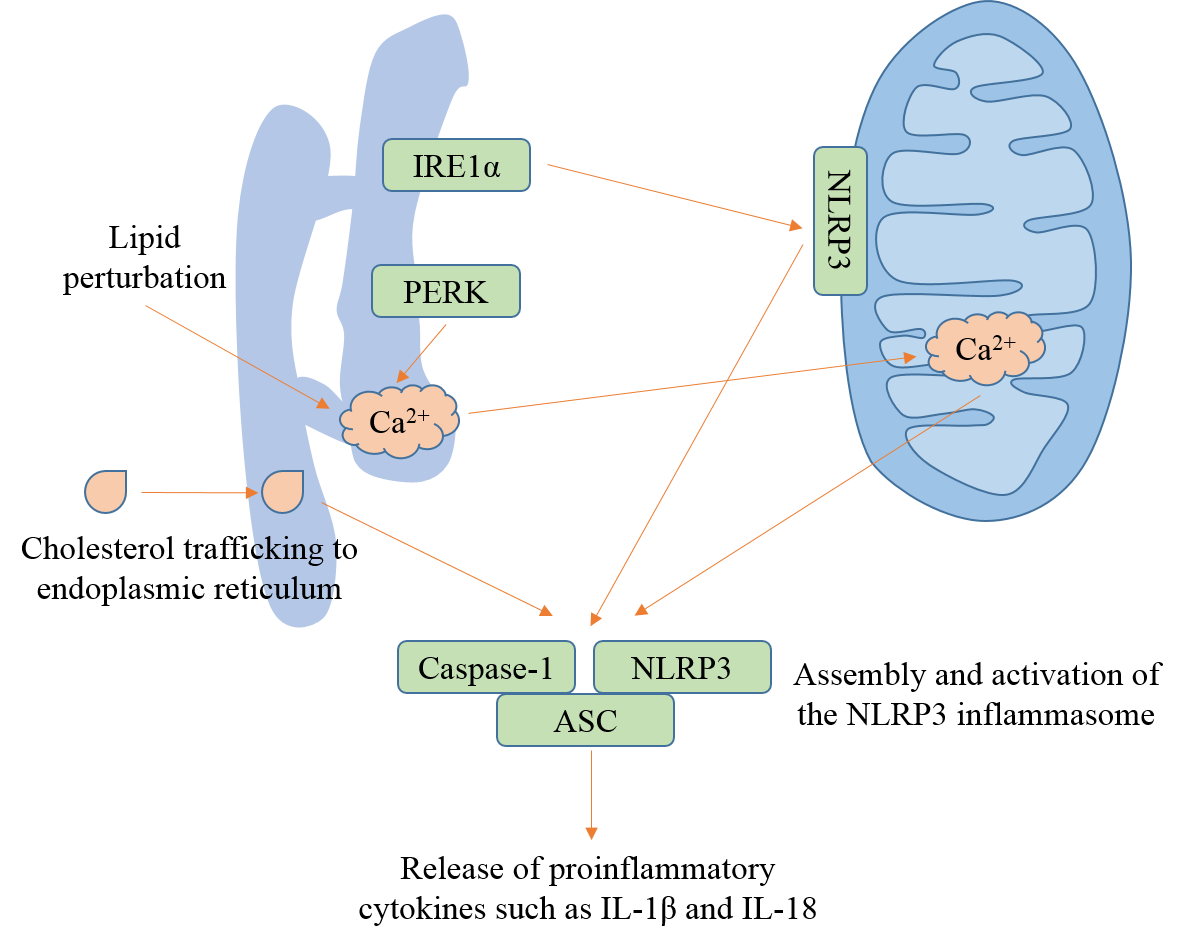
图1 内质网调控NLRP3炎性小体的激活
早在1961年电子显微镜下发现小鼠和成年豚鼠卵巢的线粒体结合的内质网膜(mitochondria-associated ER membranes,MAMs)存在连续的部分,并在1990年大鼠肝脏中作为独特的结构成分分离出来。MAMs的间隙约10-25nm,为NLRP3的激活提供了环境。线粒体释放的DNA被活性氧簇(ROS)氧化,以及迁移到线粒体外膜的心磷脂结合并激活NLRP3,引起NLRP3募集ASC和caspase-1,组装形成NLRP3炎性小体。内质网钙离子储库释放的钙离子可迅速被线粒体摄取激活NLRP3炎性小体。内质网应激过程中,NF-κB通路激活,促进NLRP3炎性小体中的NLRP3及其底物IL-1β表达上调,即致敏(priming),同时IRE1α和PERK与BiP解离,促进NLRP3定位到NLRP3以及凋亡(apoptosis)的发生,凋亡作为NLRP3炎性小体的第二信号,促进其激活。脂质是细胞膜的重要组成成分,并参与信号转导。内质网中卵磷脂/磷脂酰肌醇胺比例升高,引起钙离子转运活性增强,钙离子从储库中快速迁移出去,引起胞浆游离的钙离子浓度升高,游离的钙离子被线粒体摄入后激活NLRP3炎性小体。胆固醇是一种重要的脂质,胆固醇迁移进入内质网后促进炎性小体活化。
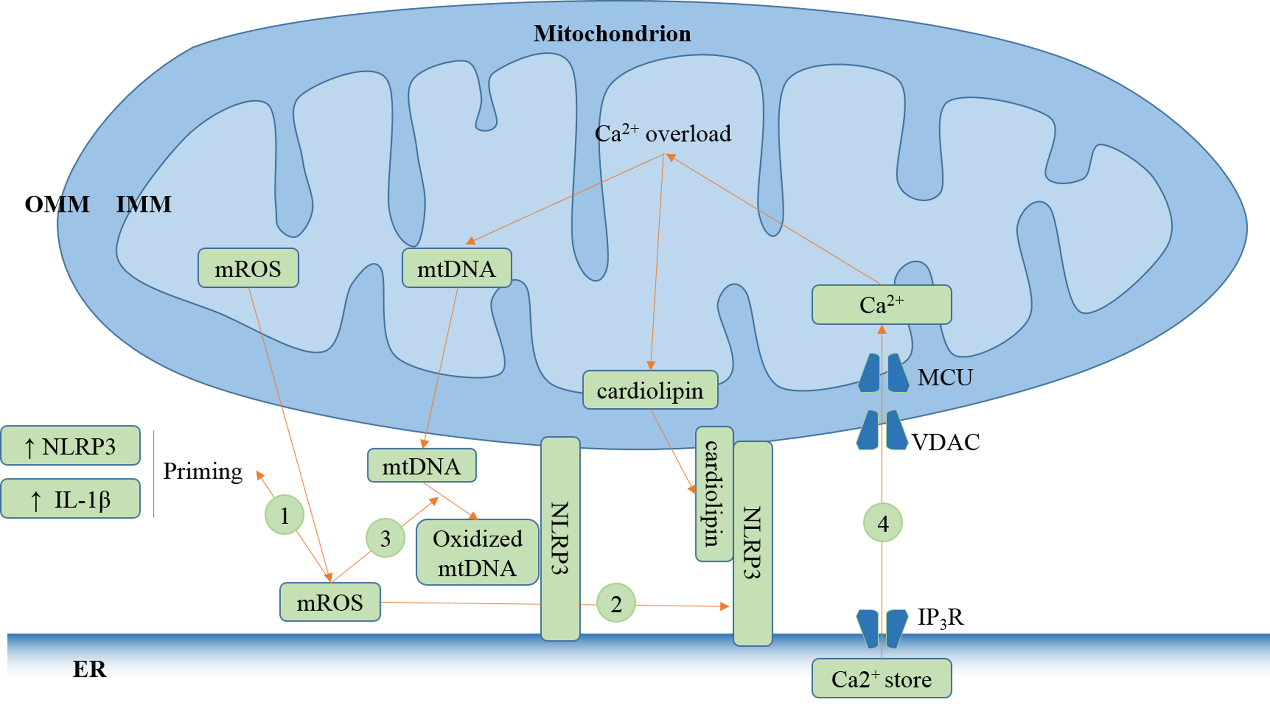
图2 MAMs为NLRP3炎性小体激活提供环境
该研究工作得到了国家自然科学基金(31802158)、重庆市基础与前沿研究计划(cstc2017jcyjAX0361)、中央高校基本科研业务费(XDJK2019C093)的资助。
文章链接:https://www.mdpi.com/2073-4409/9/5/1219
(免疫学研究中心供稿)