医学研究院-免疫学研究中心焦寒伟课题组在布鲁氏菌兼性胞内寄生机制领域获新进展
发布时间:2021-04-08 18:37:40
近期,我校动物医学院、医学研究院免疫学研究中心-焦寒伟课题组在International Journal of Molecular Sciences杂志(影响因子IF:4.556),在线发表了题为“The Mechanism of Facultative Intracellular Parasitism of Brucella”的论文。
布鲁氏菌病是一种高度流行的人畜共患传染性疾病,其特征是妊娠动物流产和生殖功能障碍,且严重影响畜牧业、旅游业和国际贸易的发展。布鲁氏菌(Brucella)最初被描述为一种兼性细胞内寄生细菌,它能够在巨噬细胞、树突状细胞和滋养层细胞中复制。
布鲁氏菌通过脂筏与宿主细胞膜发生相互作用,进入宿主细胞后形成被吞噬小泡包裹的胞内吞噬小体(Brucella-containing vacuole,BCV)。布鲁氏菌在感染宿主细胞8至12h后,通过与内小体和溶酶体(Lysosomes, Lys)的相互作用,BCV获得一些宿主的标记分子,在膜结合液泡中进行内小体成熟,从而形成酸化的内小体,此时的BCV被称为eBCV(endosomal Brucella-containing vacuole)。随着BCV的发育成熟,Ⅳ型分泌系统(Type IV secretory system, T4SS)介导的效应蛋白与内质网(Endoplasmic reticulum, ER)出口位点的相互作用,并获得ER和高尔基衍生膜。eBCV失去早期获得的宿主标记分子后,获得溶酶体标记分子,如Rab7、LaMP-1等。逃脱溶酶体降解作用的BCV将到达ER,以依赖于Sar1和Rab2的方式与ER发生融合,此时的BCV被称为rBCV(replicative Brucella-containing vacuole)。感染后期,rBCV会转变为aBCV(autophagic Brucella-containing vacuole),此时的aBCV不会继续成熟杀伤宿主细胞。至此,布鲁氏菌在细胞内经过复杂的囊泡运转,最终完成细菌的繁殖和释放,启动新一轮细胞感染。
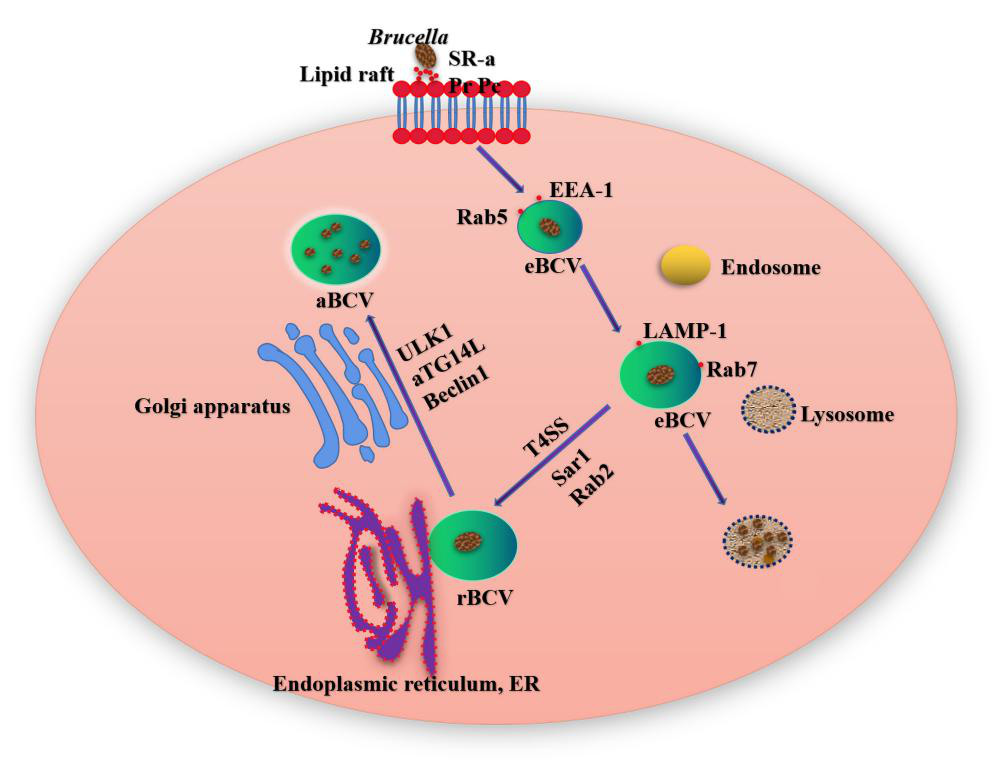
图1. 布鲁氏菌胞内转运过程
VirB操纵子编码的Ⅳ型分泌系统(Type IV secretory system, T4SS)作为布鲁氏菌的重要毒力因子,影响布鲁氏菌在宿主细胞内的存活和复制。T4SS主要分为以下五个部分:伸长区由VirB2组成;中央区和外膜区由VirB7、VirB9和VirB10组成;连接区由VirB5和VirB10组成;内膜区由VirB3、VirB4、VirB6、VirB8和VirB10组成;ATP能区由VirB4和VirB4和VirB11组成。T4SS在这一系列过程中发挥着重要作用,如细胞内晚期和溶菌酶标志物、内质网(endoplasmic reticulum, ER)标志物识别和作用于分泌途径、自噬标志物识别、对恶劣细胞内环境的抵抗和免疫途径活化的调节。
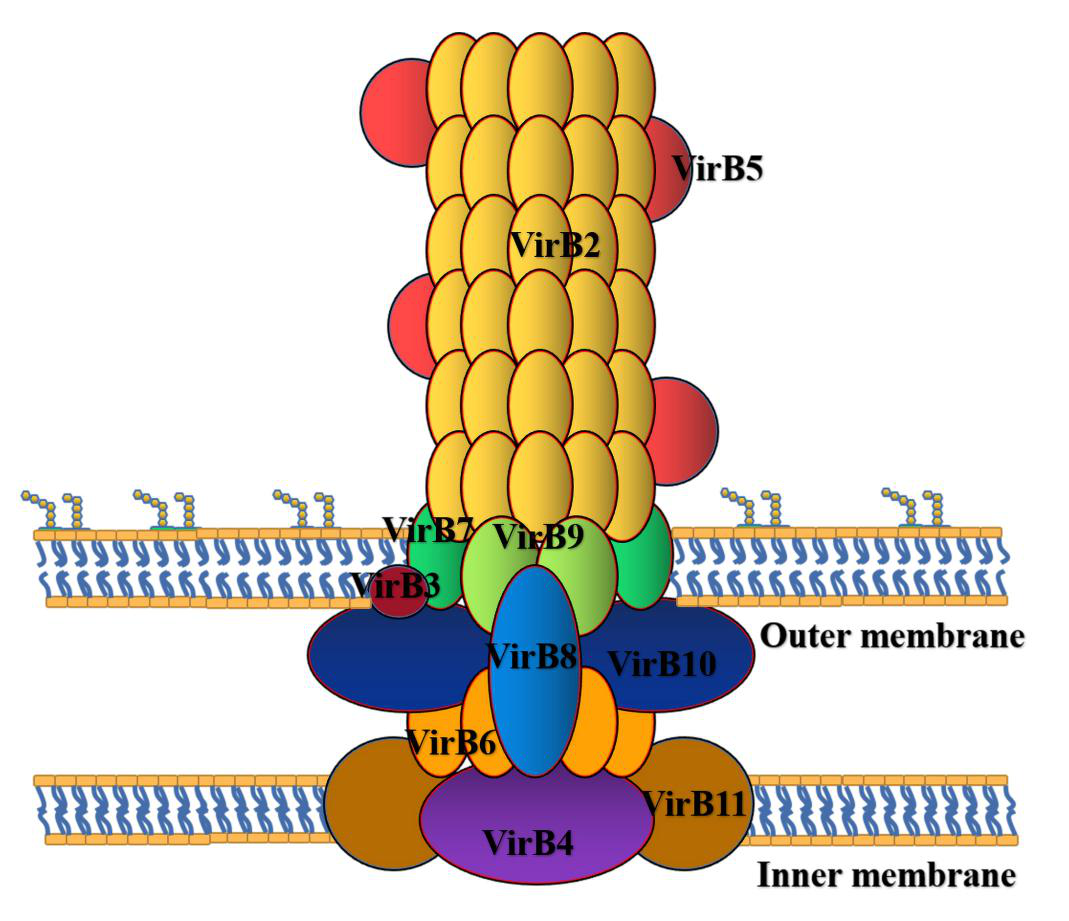
图2. 布鲁氏菌T4SS结构组成
作为第一道免疫防线,先天免疫应答在保护机体免受病原体侵害的过程中起着非常重要的作用,布鲁氏菌在与机体的相互作用中进化出许多干扰先天免疫识别和应答的机制。布鲁氏菌的脂质A含有较长的脂肪酸链(C28),这大大降低了其内毒素特性。细菌LPS的O链中含有游离羟基残基,有利于与补体C3结合。但是布鲁氏菌的O链缺少游离羟基。补体C3可通过与布鲁氏菌LPS特异性O链的接触抑制C3a和C5a的产生,从而避免宿主免疫系统的捕获。同时,布鲁氏菌的脂多糖(Lipopolysaccharide, LPS)有许多长的侧链,阻止了膜攻击复合物与细胞膜的接触。
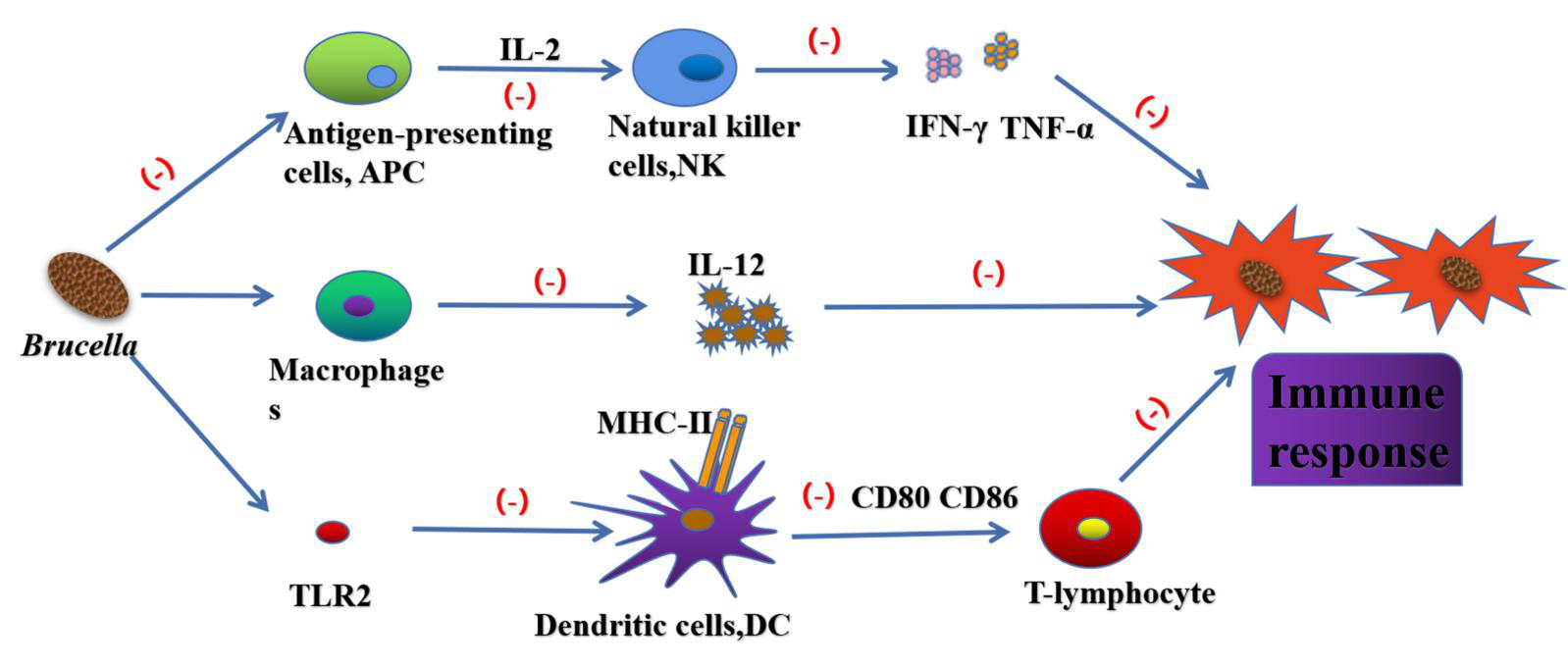
图3. 布鲁氏菌逃避宿主免疫反应途径
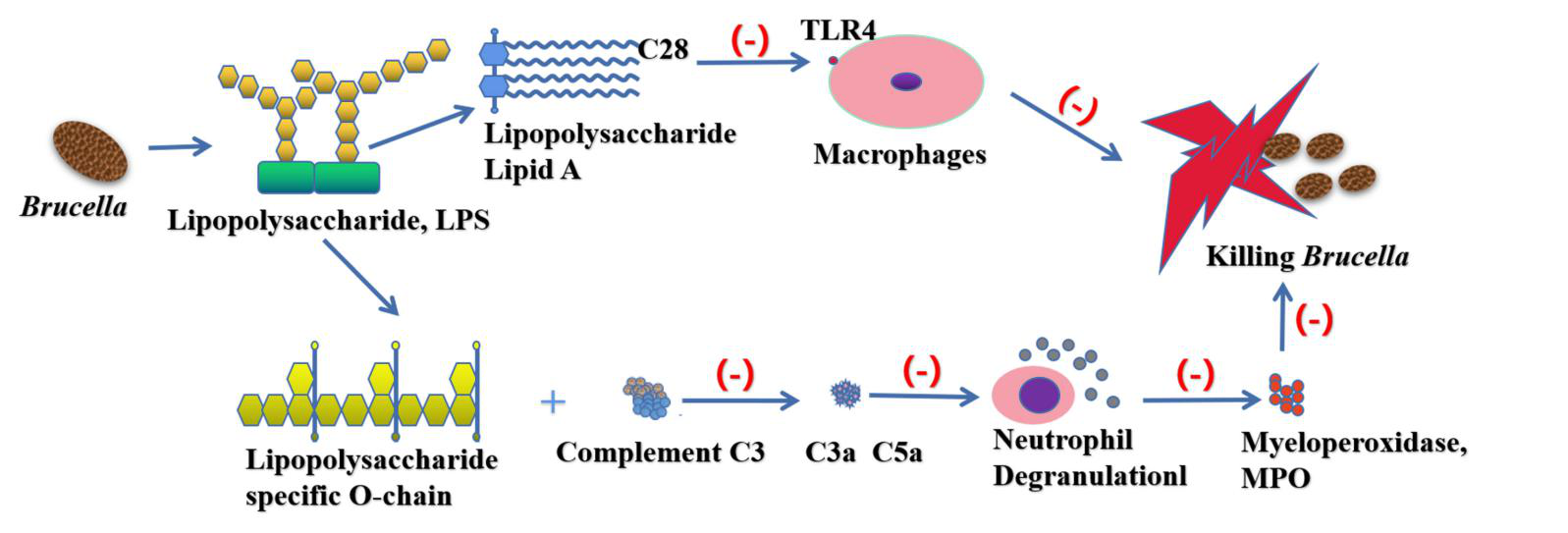
图4. 脂多糖在布鲁氏菌免疫逃避中的作用
布鲁氏菌不仅具有抵抗吞噬杀菌作用的能力,而且能使宿主细胞形成有利于其生存、繁殖和复制的微环境,并在宿主细胞中长期存活,最终导致慢性持续感染的形成。布鲁氏菌的胞内寄生和免疫逃避机制一直成为布鲁氏菌病防治的难题。该论文对布鲁氏菌的兼性细胞内寄生和免疫逃逸机制进行探索,为布鲁氏菌致病机理的研究奠定了重要基础。
西南大学动物医学院、医学研究院免疫学研究中心-焦寒伟老师为第一作者兼通讯作者,该研究工作得到了国家自然科学基金(31802215)、中央高校基本科研业务费(XDJK2020C022, XDJK2019C024)、重庆市自然科学基金(cstc2018jcyjA0807)等项目的资助。
原文链接:https://doi.org/10.3390/ijms22073673