医学研究院癌症研究中心在肿瘤的化学修饰调控等领域取得新进展
发布时间:2020-03-05 14:42:25
癌症是威胁人类生存健康的重大疾病之首,因此研究其发生发展的分子机理有助于进一步探索治疗癌症的新方法。医学研究院成立一年以来,癌症研究中心团队在崔红娟教授的带领之下,以医学研究院为单位共发表25篇学术论文,其中高质量高影响的文章有11篇。这些研究成果主要集中在肿瘤细胞中的化学修饰调控包括表观遗传修饰和蛋白质翻译后修饰的作用及其机理,肿瘤靶向治疗基础研究,以及用家蚕为疾病模型进行的天然免疫调控的探索研究。
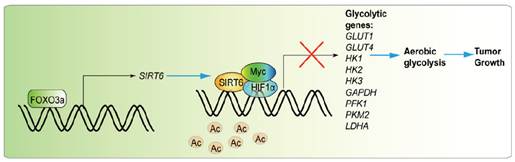
图1 FOXO3a促进去乙酰化转移酶SIRT6 的表达,从而抑制Myc和HIF1a调控的有氧糖酵解,进而抑制肿瘤的生长。
首先在癌症发生发展的表观遗传调控方面,解析了组蛋白修饰的多种酶在肿瘤发生中的作用。表观遗传修饰作为基因转录调控的一种重要调控方式,主要包含DNA修饰和组蛋白修饰,这些修饰通过一些修饰催化酶(Writer)、去修饰催化酶(Eraser)和修饰识别因子(Reader)作用。在肿瘤中有些修饰及其修饰酶的表达却发生了明显的异常,但是这些表观遗传修饰对肿瘤恶性表型的作用及其作用机制尚未清楚。解析这些异常变化的分子机制有助于进一步了解肿瘤发生发展的分子机制,为其治疗提供参考。该团队通过大数据分析发现调控表观遗传修饰的多种酶在肿瘤中表达异常,并进一步探索分析了这些酶的调控机制。比如,该团队解析了组蛋白H3的第79位赖氨酸(H3K79)甲基化转移酶DOT1L通过表观遗传机制转录激活原癌基因c-Myc的分子机制。而组蛋白甲基化转移酶G9a也被证明能够在胃癌细胞中转录激活mTOR,从而调控细胞自噬。还发现FOXO3a可以转录调控去乙酰化转移酶SIRT6表达进而调控胶质母细胞瘤和黑色素瘤细胞内有氧糖酵解(图1)。此外,该团队还阐释了一些当年研究前沿的科学问题,如率先定义了线粒体表观遗传学(Mitoepigenetics)的科学定义:包含mtDNA修饰、mtRNA修饰、类核蛋白修饰及非编码RNA调控作用,并阐释了其在癌症中扮演的相关角色(图2)。此外,该团队还阐释了组蛋白去乙酰化转移酶家族Sirtuins蛋白在肿瘤发生发展中的作用。这些研究结果阐释了表观遗传学在癌细胞病理进程中的重要作用及其分子生物学的作用机制,为癌症的治疗奠定理论基础。
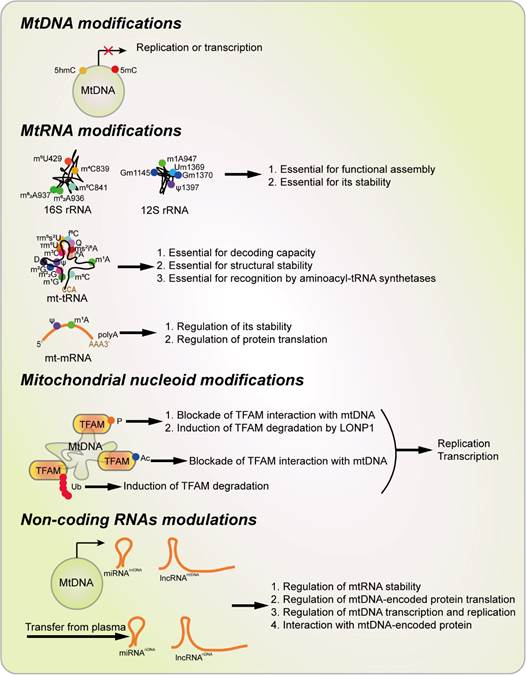
图2 线粒体表观遗传学的科学定义
蛋白质翻译后调控对于蛋白质的活性、稳定性及结合特征等多方面特性具有重要的调控作用,尤其是泛素化调控对于蛋白质的降解调节至关重要。在肿瘤中,蛋白质的调控稳态被打破,然而详细的作用及机制尚待探索。该团队针对胶质母细胞瘤的临床特征,解析了癌细胞中数个重要蛋白质的转录后调控机制。比如,解析了核仁和纺锤体相关蛋白1(NUSAP1)通过其SAP结构域进而泛素化依赖性地调控线粒体损伤应激相关蛋白ATR蛋白稳定性的分子机制,从而阐释了胶质母细胞瘤化疗耐药性的分子机理。此外,还解析了TRIP13通过转录抑制促进蛋白质降解的泛素连接酶FBXW7的稳定性进而维持胶质母细胞瘤中原癌基因c-Myc表达的分子机制。这些研究从蛋白质翻译后修饰的角度阐释了肿瘤的病理进程,为肿瘤进一步的治疗提供理论依据。
除此之外,该团队在肿瘤的靶向治疗方面,也发现了一些重要的肿瘤特异性靶标以及一些特异性作用的药物,如替加环素在多种肿瘤中的应用。该团队还以家蚕作为疾病模型,探讨研究了多种生物医学研究领域内重要生物学过程的分子机制,尤其是在天然免疫的调控机理方面取得了诸多原创性研究成果。
代表性论文(按时间倒序):
1. Zhao, Y; He, J; Li, Y; Lv, S; Cui, H. NUSAP1 potentiates chemoresistance in glioblastoma through its SAP domain to stabilize ATR. Signal Transduction and Targeted Therapy 2020 (Accepted)
2. Yang, L.; Shi, P.; Zhao, G.; Xu, J.; Peng, W.; Zhang, J.; Zhang, G.; Wang, X.; Dong, Z.; Chen, F., et al. Targeting cancer stem cell pathways for cancer therapy. Signal Transduction and Targeted Therapy 2020, 5, 8, doi:10.1038/s41392-020-0110-5.
3. Yang, R.; Li, X.; Wu, Y.; Zhang, G.; Liu, X.; Li, Y.; Bao, Y.; Yang, W.; Cui, H. EGFR activates GDH1 transcription to promote glutamine metabolism through MEK/ERK/ELK1 pathway in glioblastoma. Oncogene 2020, 10.1038/s41388-020-1199-2, doi:10.1038/s41388-020-1199-2.
4. Zhao, E.; Hou, J.; Cui, H. Serine-glycine-one-carbon metabolism: vulnerabilities in MYCN-amplified neuroblastoma. Oncogenesis 2020, 9, 14, doi:10.1038/s41389-020-0200-9.
5. Dong, Z.; Pu, L.; Cui, H. Mitoepigenetics and Its Emerging Roles in Cancer. Frontiers in Cell and Developmental Biology 2020, 8, 4-4, doi:10.3389/fcell.2020.00004.
6. Zhao, E.; Hou, J.; Ke, X.; Abbas, M.N.; Kausar, S.; Zhang, L.; Cui, H. The Roles of Sirtuin Family Proteins in Cancer Progression. Cancers 2019, 11, doi:10.3390/cancers11121949.
7. Yang, L.; Lei, Q.; Li, L.; Yang, J.; Dong, Z.; Cui, H. Silencing or inhibition of H3K79 methyltransferase DOT1L induces cell cycle arrest by epigenetically modulating c-Myc expression in colorectal cancer. Clinical Epigenetics 2019, 11, 199, doi:10.1186/s13148-019-0778-y.
8. Yin, C.; Ke, X.; Zhang, R.; Hou, J.; Dong, Z.; Wang, F.; Zhang, K.; Zhong, X.; Yang, L.; Cui, H. G9a promotes cell proliferation and suppresses autophagy in gastric cancer by directly activating mTOR. The FASEB journal 2019, 33, 14036-14050, doi:10.1096/fj.201900233RR.
9. Li, J.; Ye, J.; Zhu, S.; Cui, H. Down-Regulation of Phosphoribosyl Pyrophosphate Synthetase 1 Inhibits Neuroblastoma Cell Proliferation. Cells 2019, 8, doi:10.3390/cells8090955.
10. Zhang, G.; Zhu, Q.; Fu, G.; Hou, J.; Hu, X.; Cao, J.; Peng, W.; Wang, X.; Chen, F.; Cui, H. TRIP13 promotes the cell proliferation, migration and invasion of glioblastoma through the FBXW7/c-MYC axis. British Journal of Cancer 2019, 121, 1069-1078, doi:10.1038/s41416-019-0633-0.
11. Nadeem Abbas, M.; Kausar, S.; Wang, F.; Zhao, Y.; Cui, H. Advances in Targeting the Epidermal Growth Factor Receptor Pathway by Synthetic Products and Its Regulation by Epigenetic Modulators As a Therapy for Glioblastoma. Cells 2019, 8, doi:10.3390/cells8040350.
(医学研究院癌症研究中心供稿)